Il termine processo di corrosione si riferisce alla reazione che provoca la corrosione di un materiale metallico con il suo ambiente. Il processo di corrosione, noto anche come reazione di corrosione, è una reazione di confine di fase, poiché di solito parte dalla superficie di un materiale.
La causa della reazione di corrosione è l'instabilità termodinamica dei metalli contro agenti ossidanticome l'aria o i fluidi acquosi. Ciò significa che i metalli possono reagire con l'ossigeno rilasciando elettroni. I metalli, come l'acciaio , hanno quindi la tendenza a rilasciare l'energia introdotta durante la produzione dell'acciaio e a trasformarsi in uno stato termodinamicamente più stabile e ossidico. La corrosione può quindi essere considerata anche come una sorta di inversione del processo di produzione e i prodotti di corrosione che si formano in questo processo hanno spesso la stessa composizione dei minerali naturali.
A seconda delle proprietà dei partner di reazione, cioè del sistema di corrosione, la reazione di corrosione può essere una reazione chimica o elettrochimica, così come un processo metallo-fisico. Le reazioni chimiche di corrosione sono, per esempio, processi di dissoluzione del vetro e della ceramica in alcali, cioè in soluzioni basiche con un alto valore di pH, o la dissoluzione della plastica in solventi. Un processo di corrosione metallo-fisica è ad esempio l'infragilimento dei materiali metallici da parte dell'idrogeno, che penetra nel metallo per diffusione.
La reazione di corrosione che si verifica prevalentemente nella pratica è la reazione elettrochimica. Ciò avviene in presenza di un mezzo conduttore di ioni trasportando elettricamente le cariche attraverso atomi o molecole cariche. Un tale mezzo è chiamato elettrolita, che può essere ad esempio acqua con sali disciolti in esso. Questo elettrolita, se a diretto contatto con un materiale metallico, può causare la corrosione di quest'ultimo.
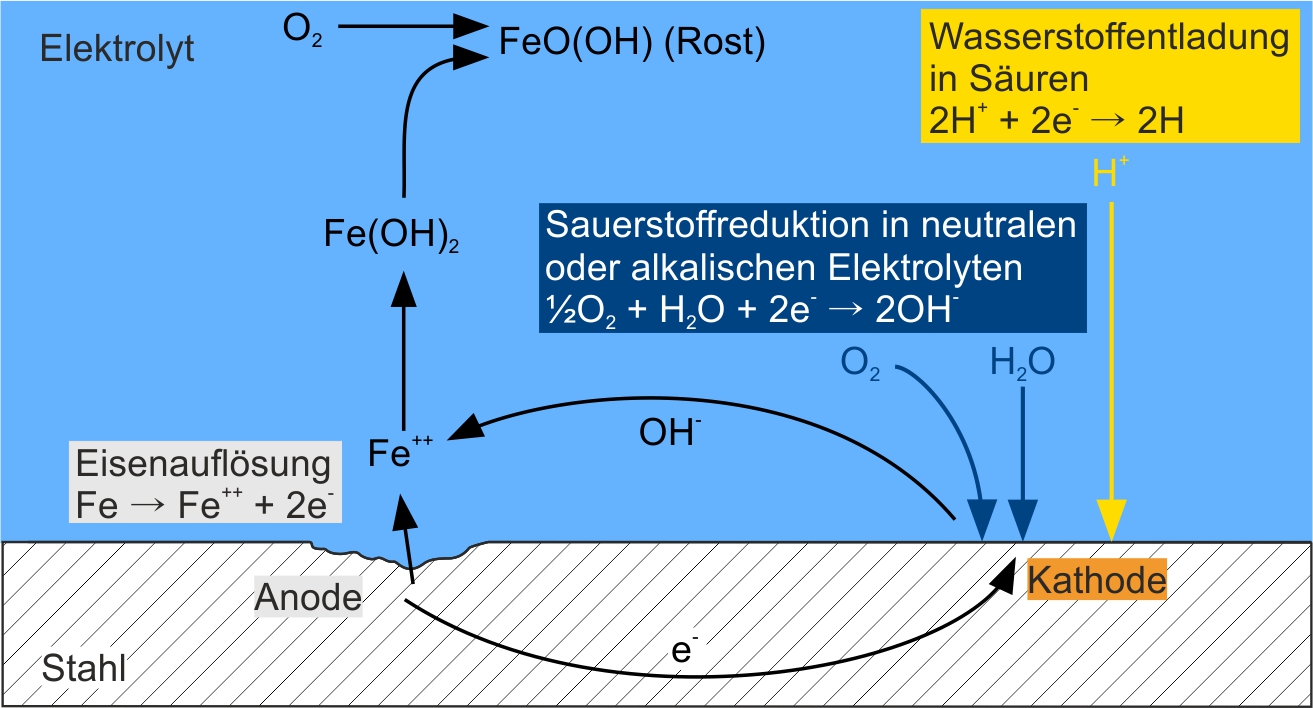
La seguente illustrazione mostra schematicamente il processo di corrosione dell'acciaio in elettroliti acquosi. Il luogo dove il ferro si dissolve si chiama anodo. All'anodo, gli atomi di ferro solido (Fe) dell'acciaio si dissolvono con il rilascio di elettroni(e-), dando luogo a ioni di ferro (Fe++). Gli elettroni migrano attraverso l'acciaio verso il catodo dove vengono consumati da una riduzione di ossigeno o da una scarica di idrogeno. Quale delle due reazioni avviene dipende dal tipo di elettrolita. La riduzione dell'ossigeno avviene in mezzi neutri e alcalini, dove l'ossigeno (O2), l'acqua (H2O) e gli elettroni rilasciati all'anodo reagiscono per formare ioni idrossido (OH-). Negli acidi, cioè elettroliti con un basso valore di pH, avviene una scarica di idrogeno. Qui gli ioni H+ dell'acido reagiscono con gli elettroni e si forma l'idrogeno atomico (H).
Gli ioni idrossido che si formano durante la scarica di ossigeno si muovono a loro volta attraverso l'elettrolita verso l'anodo, dove si combinano con gli ioni di ferro (Fe++) in soluzione per formare idrossido di ferro (Fe(OH)2). Quando viene aggiunto ossigeno, l'idrossido di ferro(II) reagisce per formare l'idrossido di ferro(III) parsimoniosamente solubile (FeO(OH)), la ruggine effettiva sull'acciaio.

La corrosione può avvenire solo se la dissoluzione del ferro all'anodo e il consumo di elettroni al catodo, cioè tramite una riduzione dell'ossigeno o una scarica di idrogeno, possono avvenire ugualmente. Inoltre, sia la conducibilità elettrica del metallo che la conducibilità ionica dell'elettrolita devono essere presenti affinché avvenga uno scambio di carica. Si forma così un circuito chiuso in un elemento di corrosione. L'ostruzione deliberata di una di queste condizioni inibisce la corrosione e viene chiamata protezione attiva contro la corrosione.
Reazione alla corrosione
corrosion prozess, corrosion reaction